| Tiene problemas para visualizar este email? Ver aquí |
|
|
|||||||||||
 |
|||||||||||
|
|
|||||||||||
| Junio 2015 . Edición 102 | |||||||||||
| Contenidos de esta edición: | |||||||||||
|
|
|||||||||||
|
|
|||||||||||
|
|
|||||||||||
| Salud | |||||||||||
|
|
|||||||||||
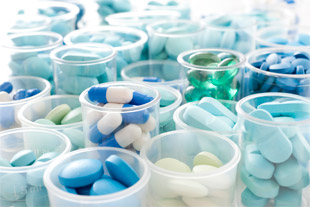
| Sostenido trabajo por la Trazabilidad en el Sector Salud | |||||||||||
|
|||||||||||
El comercio ilegal de medicamentos, la falsificación, la adulteración, fueron parte de los motivos que causaron durante mucho tiempo numerosos perjuicios en la salud de muchos pacientes, una parte muy vulnerable de la sociedad que requiere la máxima atención y eficiencia de las autoridades responsables. ANMAT, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica de nuestro país, cumpliendo con la necesidad de acabar con este flagelo y en virtud de la recomendación de la Organización Mundial de la Salud para que cada país cuente con una autoridad regulatoria y un marco normativo durante todo el ciclo de vida de un producto medicinal, ha trabajado durante muchos años y en forma insistente hasta que el 31 de mayo de 2011 dispuso un Sistema de Trazabilidad de Medicamentos para ser implementado por las personas físicas o jurídicas que intervengan en la cadena de comercialización, distribución y dispensación de especialidades medicinales. El Sistema de Trazabilidad dispuesto incluyó la utilización de los códigos de identificación de los estándares GS1, y su aplicación en diferentes etapas. En el año 2012, el 28 de marzo, se dio a conocer una nueva disposición, la 1831/2012, dado que como decía en su primera parte “resulta imprescindible continuar con el proceso iniciado en virtud de la implementación del Sistema Nacional de Trazabilidad”. Entre las medidas de aplicación en esta nueva etapa se disponía que:
Dos años más tarde, el 15 de abril de 2014, ANMAT da a conocer la Disposición 2303 que se extiende a Productos Médicos, incluyendo en una primera etapa: cardiodesfibriladores/cardioversores, estimuladores eléctricos para la audición en la cóclea, lentes intraoculares, marcapasos cardíacos, prótesis de mama internas, stents, prótesis de cadera y prótesis de columna. Es así como llegamos a este año, al 30 de enero, en que ANMAT publica en el Boletín Oficial la Disposición 963/15 que dice que “habiéndose cumplido ya una primera etapa de implementación del Sistema Nacional de Trazabilidad con resultados más que favorables, resulta imprescindible continuar con el proceso gradual de implementación de la trazabilidad, definiendo nuevos lineamientos técnicos y características del sistema”. La reciente Disposición en su artículo primero dice que “el Sistema de Trazabilidad establecido, deberá encontrarse implementado para la totalidad de las especialidades medicinales antes enunciadas, para el primer día hábil de marzo de 2015, para todos los eslabones de la cadena de distribución”, mientras que en el artículo tercero agrega que “en todos los casos, se deberá garantizar que la calidad de impresión de los códigos sea óptima y permita su lectura de manera eficaz y sin inconvenientes a lo largo de toda la cadena y el período de vida útil del medicamento. Asimismo, se deberán efectuar los controles de calidad necesarios sobre el soporte utilizado, de forma tal de garantizar que la calidad del mismo imposibilite su remoción sin dejar una marca evidente en el empaque del producto, y que resista las condiciones de almacenamiento necesarias de éste. Los laboratorios titulares de certificados de registro de Especialidades Medicinales de productos deben proceder a realizar verificación y pre-verificación de códigos ante la organización GS1 a fin de asegurar su correcta codificación y legibilidad. Se deberán enviar muestras de los códigos a imprimir para verificar que las simbologías se encuentren bajo los parámetros del Estándar GS1, y repetirse el procedimiento ante cualquier cambio en los insumos, materias primas, métodos de impresión o de tecnologías de impresión”. En cuanto al artículo 11 aclara que “Para el caso de exportación de unidades con soporte de trazabilidad ya colocado, el agente exportador deberá informar como destino el código de país correspondiente según el estándar GS1. Sin perjuicio de ello, no será obligatorio trazar unidades destinadas a exportación, salvo que ya tuvieran informes de movimientos logísticos previos”. La implementación del Sistema de Trazabilidad de Medicamentos ha incluido este año también una actualización informática según la cual “ANMAT comunica a los usuarios del Sistema Nacional de Trazabilidad de Medicamentos que a partir del 13 de julio de 2015, no podrán informarse transacciones de recepción de especialidades medicinales alcanzadas por la Disposición ANMAT 3683/11 de forma manual. Es decir, que ya no se permitirá utilizar la pantalla de “Movimientos -> Informar” para informar la recepción de esos medicamentos. En esos casos, será obligatorio confirmar las recepciones enviadas por su proveedor, utilizando la pantalla de “Movimientos -> Transacciones Pendientes de Confirmación”. Este cambio también aplicará al uso de webservices, por lo que si cuentan con un sistema propio que informa los movimientos hacia el Sistema de Trazabilidad, sugerimos reenviar este mensaje a su proveedor de soporte informático”. El trabajo por mejorar la eficiencia en el sector de la salud ha sido sostenido tanto por parte de ANMAT como de GS1 Argentina, que con capacitación, asesoramiento y acompañamiento en las implementaciones continúa brindando su experiencia y su apoyo incondicional. |
|||||||||||
|
|||||||||||
|
|
| ©2015 GS1 Argentina, Fraga 1326
(C1427BUB) Ciudad de Buenos Aires, Argentina www.gs1.org.ar |
| Política de Privacidad |